Zepbound: cos'è e come funziona questo farmaco per dimagrire
Zepbound è un farmaco pensato per favorire il dimagrimento, a base di tirzepatide. Attualmente non è disponibile per l’acquisto in Italia.

Zepbound è un farmaco pensato per favorire il dimagrimento, a base di tirzepatide. Attualmente non è disponibile per l’acquisto in Italia.
Cos'è Zepbound?
Zepbound è un farmaco iniettabile a base di tirzepatide, disponibile solo su prescrizione medica e da usare una volta a settimana tramite iniezione sottocutanea. Non è un integratore dimagrante da banco, ma un medicinale che va assunto esclusivamente all’interno di un percorso clinico controllato.
La tirzepatide agisce su due recettori coinvolti nella regolazione dell’appetito e del metabolismo: GIP e GLP-1. Si tratta del primo farmaco a stimolare entrambi questi recettori, e viene fornito in penne preriempite monodose con dosaggi da 2,5 mg a 15 mg.
A cosa serve?
Zepbound viene utilizzato principalmente per la gestione del peso in adulti con obesità o sovrappeso associato a patologie correlate, e per il trattamento dell’apnea ostruttiva del sonno (OSA) nei soggetti con obesità. Viene quindi considerato un farmaco per dimagrire.
È indicato quando l’indice di massa corporea (BMI) è superiore a 30, oppure a 27 in presenza di almeno una patologia legata al peso, come prediabete, diabete di tipo 2, ipertensione, dislipidemia o appunto apnea ostruttiva del sonno. L’indicazione per il trattamento dell’apnea ostruttiva del sonno in soggetti obesi in Europa non risulta ancora autonoma
La terapia, tuttavia, deve essere abbinata a una terapia nutrizionale stilata da un professionista e a un aumento dell’attività fisica, sempre all’interno di un piano terapeutico personalizzato.
Come si assume? Somministrazione e dosaggio
Zepbound viene somministrato una volta a settimana tramite iniezione sottocutanea, usando una penna monodose.
L’iniezione può essere fatta nell’addome, nella coscia o nella parte superiore del braccio, ruotando il punto di somministrazione a ogni uso.
Non serve assumerlo a digiuno o lontano dai pasti, tuttavia è opportuno che giorno e orario rimangano gli stessi ogni settimana.
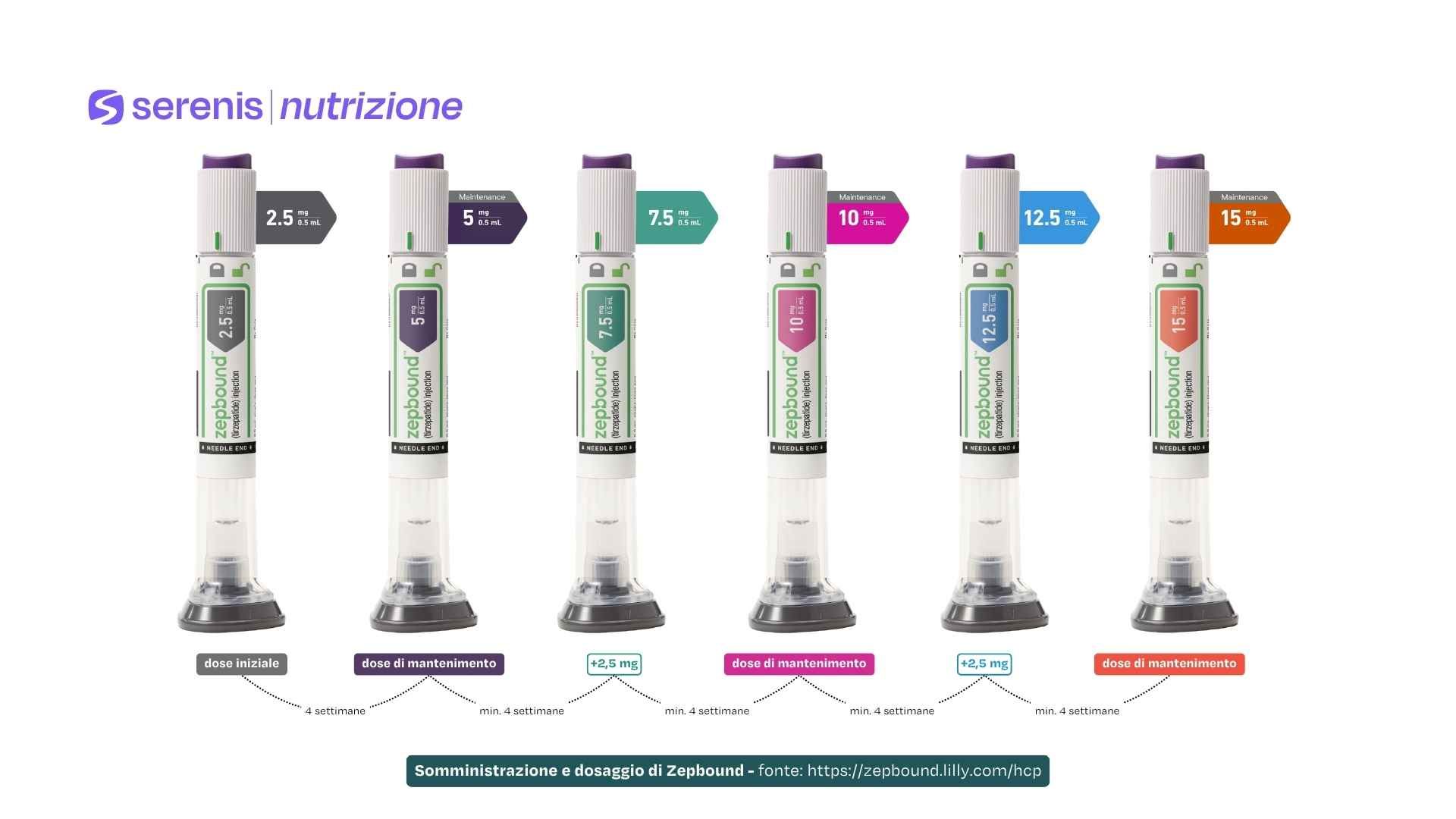
In genere il dosaggio iniziale è di 2,5 mg a settimana, per una durata pari a 4 settimane. Successivamente, il dosaggio viene aumentato ogni 4 settimane, fino a raggiungere la dose di mantenimento giudicata più adatta dal medico, solitamente tra 5 mg e 15 mg settimanali.
La prescrizione di Zepbound: come funziona?
Zepbound può essere prescritto solo da un medico, e solo in seguito ad una valutazione clinica approfondita. Non è disponibile senza ricetta e non può essere acquistato liberamente in farmacia o online. Attualmente il farmaco non è disponibile in Italia.
Il medico valuta l’idoneità al trattamento considerando:
- Il BMI del paziente;
- Eventuali patologie legate al peso;
- La presenza di condizioni che controindichino il farmaco quali:
- Gravidanza e allattamento
- Ipersensibilità a principio attivo o eccipienti
- Pancreatite acuta o pregressa
- Grave insufficienza epatica o renale
- Malattie gastrointestinali gravi (es. IBD, gastroparesi)
- Età <18 anni
- Carcinoma midollare della tiroide o MEN2
Il medico potrebbe inoltre ritenere opportuno richiedere degli esami del sangue o altri accertamenti.
Inoltre, anche durante la terapia è previsto un monitoraggio costante per verificare l’efficacia e l’eventuale necessità di modificare il dosaggio.
Detto questo, Zepbound non può essere usato insieme ad altri farmaci contenenti tirzepatide o agonisti del GLP-1, né con altri medicinali per il dimagrimento, salvo rari casi individuati dal medico.
Con Serenis Nutrizione potrai iniziare un percorso online per la gestione del peso con un’equipe di medici e nutrizionisti esperti nel trattamento di obesità, sovrappeso e dimagrimento. Dopo aver compilato il questionario e prenotato il primo colloquio gratuito, potrai iniziare sottoscrivendo un abbonamento al costo di 119 euro ogni 4 settimane.
L’approccio integrato con nutrizionista e medico (dietologo o endocrinologo) potrà essere utilizzato solo a determinate condizioni. Il nutrizionista con cui parlerai nel colloquio di orientamento gratuito risponderà a tutti i tuoi dubbi.
Scopri il percorso con un'equipe di medici e nutrizionisti specializzati in obesità, sovrappeso e dimagrimento.
Il dosaggio e l’assunzione di Zepbound
La terapia con Zepbound comincia solitamente con una dose iniziale pari a 2,5 mg una volta a settimana, per 4 settimane. Questa fase è necessaria per avviare il trattamento e per valutare la risposta dell’organismo.
Il dosaggio viene poi aumentato gradualmente ogni mese, secondo il seguente schema: 5 mg, 7,5 mg, 10 mg, 12,5 mg e infine 15 mg, che è la dose massima raccomandata. La scelta della dose di mantenimento si basa sulla risposta del paziente e sulla tollerabilità del farmaco stesso.
L’iniezione si effettua una volta a settimana, sempre nello stesso giorno. Ogni penna monodose contiene un dosaggio da 2,5 mg o superiore, e deve essere iniettata sottocute in una delle zone raccomandate, ruotando ogni volta il sito di iniezione.
Per essere conservato correttamente il farmaco va tenuto in frigorifero tra i 2 °C e gli 8 °C, nella confezione originale.
I benefici di Zepbound
Il principale beneficio di Zepbound sta nel fatto che favorisce il dimagrimento grazie all’azione combinata sui recettori GIP e GLP-1. Di conseguenza:
- Riduce la sensazione di fame;
- Prolunga il senso di sazietà;
- Rallenta lo svuotamento gastrico;
- Migliora il metabolismo glicolipidico.
Può essere dunque potenzialmente utile per la perdita di peso negli adulti con obesità, oppure con sovrappeso legato a patologie associate.
È stato autorizzato anche per trattare l’apnea ostruttiva del sonno, in quanto la perdita di peso può contribuire a ridurre i sintomi respiratori e migliorare di conseguenza il riposo notturno.
Tuttavia, non si tratta né di un farmaco “miracoloso”, né di una soluzione rapida. È infatti potenzialmente efficace solo se inserito in un programma di dimagrimento strutturato sostenuto da un professionista, composto da una dieta bilanciata e da uno stile di vita sano con annessa attività fisica regolare.
I potenziali risultati
I dati clinici mostrano una perdita di peso significativa con Zepbound. Il dimagrimento è graduale, ma con progressi visibili già nelle prime settimane di trattamento.
Le dosi più alte tendono a produrre risultati migliori, ma anche con dosaggi inferiori si osservano effetti apprezzabili, a seconda della risposta del paziente.
Detto questo, l’efficacia è strettamente legata alla continuità della terapia, all’adozione di un’alimentazione controllata e all’attività fisica.
Se non si raggiunge una perdita di peso clinicamente rilevante, il trattamento può essere sospeso o modificato.
Gli effetti collaterali e i rischi
Gli effetti indesiderati più frequenti che è possibile riscontrare con Zepbound sono:
- Nausea;
- Diarrea;
- Vomito;
- Stitichezza;
- Dolori o crampi addominali;
- Reflusso gastroesofageo;
- Gonfiore accompagnato talvolta da eruttazione;
- Stanchezza;
- Reazioni cutanee nel punto di iniezione;
- Reazioni allergiche.
In rari casi, possono verificarsi ulteriori effetti collaterali come pancreatite, calcoli o infiammazione della colecisti, ipoglicemia (soprattutto in chi assume anche insulina o sulfoniluree), peggioramento della vista in chi ha già retinopatia diabetica e danni ai reni legati a disidratazione.
In caso di gonfiore al volto o alla gola, difficoltà respiratorie, orticaria o battito cardiaco accelerato, è necessario sospendere immediatamente il trattamento e contattare un medico.
Inoltre, non va utilizzato in gravidanza e durante l’allattamento.
In caso di dubbio è comunque possibile consultare il foglietto illustrativo di Zepbound.
Zepbound è disponibile in italia?
No, sebbene l’Aifa (Agenzia italiana per il farmaco) abbia dato il via libera per i trattamenti con tirzepatide, attualmente Zepbound non è disponibile in Italia.
Non deve poi essere confuso con altri farmaci simili già presenti sul mercato europeo, come quelli a base di semaglutide o liraglutide (Saxenda). Infatti, sebbene agiscano su recettori simili o per certi versi affini, hanno caratteristiche diverse. Stesso discorso per quanto riguarda la fentermina, la cui vendita è attualmente vietata in Italia.
Una cosa importante
Le informazioni che trovi in questo articolo hanno uno scopo divulgativo, e non sostituiscono il parere di un medico. Ogni persona reagisce in modo diverso ai farmaci, e questo vale anche per gli eventuali effetti collaterali.
Per capire cosa è meglio per te, parla con un medico e leggi bene il foglietto illustrativo.
Farmaci per dimagrire: un confronto per classi
La terapia farmacologica dell’obesità ha compiuto negli ultimi anni un salto qualitativo notevole. Dai farmaci ad azione centrale e dagli inibitori dell’assorbimento si è passati a molecole che agiscono su meccanismi ormonali profondi, modulando appetito e metabolismo.
Nonostante l’efficacia crescente, nessun farmaco può sostituire la terapia comportamentale e nutrizionale, che rimane la base di ogni percorso di riduzione ponderale.
L’approccio più corretto consiste nel selezionare il principio attivo in base al profilo metabolico, alle comorbidità e alla sostenibilità del trattamento.
- Agonisti incretinici (GLP-1 e GIP)
Principi attivi: Liraglutide, Semaglutide, Tirzepatide
Meccanismo d’azione:
Mimano l’azione degli ormoni intestinali GLP-1 (e nel caso di tirzepatide anche GIP), che regolano la secrezione insulinica, lo svuotamento gastrico e il senso di sazietà. Riducendo l’appetito e migliorando il controllo glicemico, favoriscono la perdita di peso in modo fisiologico.
Efficacia comparativa:
- Liraglutide (Saxenda®): perdita media 6–8% del peso corporeo.
- Semaglutide (Wegovy®): perdita media 12–15% (trial STEP).
- Tirzepatide (Mounjaro®/Zepbound®): fino al 26% (SURMOUNT-1 e SURMOUNT-5).
Effetti collaterali: nausea, vomito, diarrea, stipsi, raramente pancreatite o colelitiasi.
Controindicazioni (EMA/AIFA) con qualche distinzione a seconda della molecola:
- Gravidanza e allattamento
- Ipersensibilità a principio attivo o eccipienti
- Pancreatite acuta o pregressa
- Grave insufficienza epatica o renale
- Malattie gastrointestinali gravi (es. IBD, gastroparesi)
- Età <12 anni
Nota FDA: carcinoma midollare tiroideo e MEN2 citati come boxed warning negli USA, non presenti come controindicazioni nelle schede tecniche europee.
Punti di forza: efficacia elevata, miglioramento del profilo metabolico e cardiovascolare.
Criticità: costo elevato, terapia di lunga durata, somministrazione iniettabile.
Ruolo clinico: prima scelta nei pazienti con obesità associata a diabete, insulino-resistenza o sindrome metabolica.
- Farmaci antiassorbitivi
Principio attivo: Orlistat (Xenical®, Alli®, Beacita®)
Meccanismo d’azione:
Inibisce le lipasi gastrointestinali riducendo l’assorbimento di circa il 30% dei grassi alimentari.
Efficacia: perdita media 3–5% del peso corporeo, spesso utile nel mantenimento.
Effetti collaterali: steatorrea, urgenza fecale, flatulenza, deficit di vitamine liposolubili (A, D, E, K).
Controindicazioni: sindromi da malassorbimento cronico, colestasi, gravidanza, allattamento.
Punti di forza: profilo di sicurezza cardiovascolare eccellente, azione locale non sistemica.
Limiti: scarsa aderenza per disturbi gastrointestinali; efficacia dipendente da dieta ipolipidica.
Ruolo clinico: opzione “low-risk” o di mantenimento nei pazienti che non tollerano altre classi.
- Farmaci ad effetto centrale (azione sul SNC)
Principi attivi: Bupropione/Naltrexone (Mysimba®), Fentermina/Topiramato (Qsymia® – non approvato in UE)
Meccanismo d’azione:
Agiscono sui circuiti ipotalamici e dopaminergici della fame e della ricompensa.
- Bupropione/Naltrexone: potenzia la dopamina e la noradrenalina riducendo il craving alimentare.
- Fentermina/Topiramato: combina effetto anoressizzante e modulazione GABAergica (solo USA).
Efficacia: perdita media 5–10% del peso corporeo.
Effetti collaterali: insonnia, ansia, nausea, cefalea, aumento della pressione arteriosa, parestesie.
Controindicazioni:
- Ipertensione arteriosa non controllata
- Epilessia o storia di convulsioni
- Disturbi psichiatrici maggiori
- Gravidanza e allattamento
- Uso concomitante di oppioidi o sospensione recente di alcol/benzodiazepine
Nota regolatoria:
- Mysimba® è approvato in Europa e in Italia.
- Fentermina/Topiramato non è autorizzato in UE.
Ruolo clinico: utile in soggetti con alimentazione compulsiva e craving, previa valutazione psichiatrica e cardiovascolare accurata.
Tabella comparativa per classi farmacologiche
| Classe | Principi attivi (nome commerciale) | Meccanismo d’azione | Perdita media peso | Via di somministrazione | Controindicazioni principali (EMA/AIFA) | Status regolatorio (UE) | Note cliniche |
|---|---|---|---|---|---|---|---|
| Agonisti incretinici (GLP-1/GIP) | Liraglutide (Saxenda®), Semaglutide (Wegovy®), Tirzepatide (Mounjaro®/Zepbound®) | Stimolano recettori incretinici → ↑ sazietà, ↓ appetito, ↑ secrezione insulinica | 8–26% | Iniezione SC (giornaliera o settimanale) | Gravidanza, allattamento, pancreatite, insufficienza epatica/renale grave, patologie GI gravi, età <12 aa | Approvati EMA/AIFA | Classe più efficace; monitoraggio per GI e pancreas |
| Antiassorbitivi | Orlistat (Xenical®, Alli®, Beacita®) | Inibizione lipasi → ↓ assorbimento grassi | 3–5% | Orale (TID con pasti) | Malassorbimento, colestasi, gravidanza, allattamento | Approvato EMA/AIFA | Sicuro, economico, disturbi GI frequenti |
| Centrali (SNC) | Bupropione/Naltrexone (Mysimba®), Fentermina/Topiramato (Qsymia®) | Modulano dopamina, noradrenalina, GABA → ↓ craving e appetito | 5–10% | Orale | Ipertensione non controllata, epilessia, disturbi psichiatrici, gravidanza, uso di oppioidi | Mysimba® approvato EMA/AIFA; Qsymia® solo USA | Efficace nei pazienti con fame compulsiva; richiede valutazione CV e psichiatrica |
Fonti:
- Malhotra A, et al. Tirzepatide for the Treatment of Obstructive Sleep Apnea and Obesity. N Engl J Med. 2024;391(14):1685-1697. doi:10.1056/NEJMoa2401234. PubMed+1
- Wei J, et al. Glucagon-like peptide-1 receptor agonists for obstructive sleep apnea: systematic review and meta-analysis. J Transl Med. 2025;23(1):63. doi:10.1186/s12967-025-06302-y. https://link.springer.com/article/10.1186/s12967-025-06302-y
- Wilding JPH, Batterham RL, Calanna S, Davies M, Van Gaal LF, Lingvay I, et al. Once-weekly semaglutide in adults with overweight or obesity. N Engl J Med. 2021;384(11):989–1002. doi:10.1056/NEJMoa2032183.
- Jastreboff AM, Aronne LJ, Ahmad NN, Wharton S, Connery L, Alves B, et al. Tirzepatide once weekly for the treatment of obesity. N Engl J Med. 2022;387(3):205–216. doi:10.1056/NEJMoa2206038.
- Garvey WT, Birkenfeld AL, Davies MJ, Rubino DM, Ali M, Ghosh A, et al. Two-year effects of tirzepatide versus semaglutide in adults with obesity: SURMOUNT-5 trial. Nat Med. 2024;30(3):512–523. doi:10.1038/s41591-024-03125-x.
- Aronne LJ, Kushner RF, Wadden TA, Fujioka K, Greenway FL, Halpern A, et al. Tirzepatide compared with semaglutide in adults with obesity. N Engl J Med. 2025. doi:10.1056/NEJMoa2416394.
- Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M, et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med. 2015;373(1):11–22. doi:10.1056/NEJMoa1411892.
- Astrup A, Rössner S, Van Gaal L, Rissanen A, Niskanen L, Al Hakim M, et al. Effects of liraglutide in the treatment of obesity: a randomized, double-blind, placebo-controlled study. Lancet. 2009;374(9701):1606–1616. doi:10.1016/S0140-6736(09)61375-1.
- Torgerson JS, Hauptman J, Boldrin MN, Sjöström L. Xenical in the prevention of diabetes in obese subjects (XENDOS) study. Diabetes Care. 2004;27(1):155–161. doi:10.2337/diacare.27.1.155.
- Greenway FL, Fujioka K, Plodkowski RA, Mudaliar S, Guttadauria M, Erickson J, et al. Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2010;376(9741):595–605. doi:10.1016/S0140-6736(10)60888-4.
- Gadde KM, Allison DB, Ryan DH, Peterson CA, Troupin B, Schwiers ML, et al. Effects of low-dose, controlled-release phentermine plus topiramate on weight and associated comorbidities in overweight and obese adults (CONQUER): a randomized, placebo-controlled, phase 3 trial. Lancet. 2011;377(9774):1341–1352. doi:10.1016/S0140-6736(11)60205-5.
- European Medicines Agency. European public assessment report (EPAR): Wegovy (semaglutide). Updated 2024 [Internet]. Amsterdam: EMA; 2024 [cited 2025 Oct 28]. Available from: https://www.ema.europa.eu/en/medicines/human/EPAR/wegovy
- European Medicines Agency. EPAR: Saxenda (liraglutide). Updated 2024 [Internet]. Amsterdam: EMA; 2024 [cited 2025 Oct 28]. Available from: https://www.ema.europa.eu/en/medicines/human/EPAR/saxenda
- European Medicines Agency. EPAR: Mounjaro (tirzepatide). Updated 2025 [Internet]. Amsterdam: EMA; 2025 [cited 2025 Oct 28]. Available from: https://www.ema.europa.eu/en/medicines/human/EPAR/mounjaro
- European Medicines Agency. EPAR: Mysimba (naltrexone/bupropion). Updated 2024 [Internet]. Amsterdam: EMA; 2024 [cited 2025 Oct 28]. Available from: https://www.ema.europa.eu/en/medicines/human/EPAR/mysimba
- European Medicines Agency. EPAR: Xenical (orlistat). Updated 2024 [Internet]. Amsterdam: EMA; 2024 [cited 2025 Oct 28]. Available from: https://www.ema.europa.eu/en/medicines/human/EPAR/xenical
- American Diabetes Association. 8. Pharmacologic approaches to glycemic treatment: Standards of Care in Diabetes—2024. Diabetes Care. 2024;47(Suppl 1):S138–S153. doi:10.2337/dc24-S008.
- Garvey WT, Mechanick JI, Brett EM, Garber AJ, Hurley DL, Jastreboff AM, et al. Obesity algorithm 2024 [Internet]. Denver (CO): Obesity Medicine Association; 2024 [cited 2025 Oct 28]. Available from: https://obesitymedicine.org/resources/obesity-algorithm/